Klinische Studien: Abgrenzung Arzneimittelrecht und Gentechnikgesetz
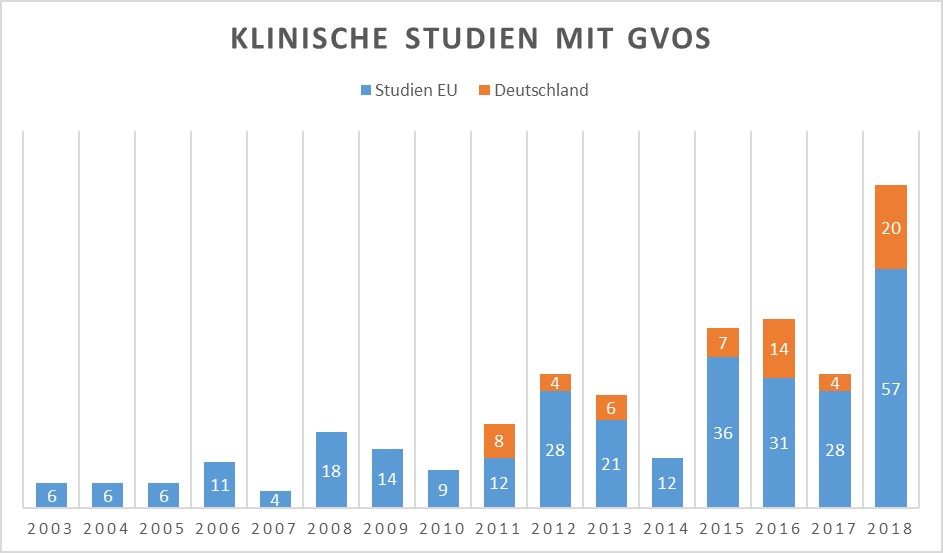
Die Anzahl der klinischen Studien unter Verwendung von GVOs steigt: Das GMO Register der EU verzeichnet für 2018 bereits 77 Studien, davon 20 in Deutschland. Aber was ist hinsichtlich der Verwendung der GVOs in den Prüfzentren zu beachten?
 In 2016 gab es hierzu eine Stellungnahme des Bundesministeriums für Gesundheit (BMG) unter Mitwirkung u.a. des Paul-Ehrlich-Instituts (PEI) und des Bundesamtes für Verbraucherschutz und Lebensmittelsicherheit (BVL).
In 2016 gab es hierzu eine Stellungnahme des Bundesministeriums für Gesundheit (BMG) unter Mitwirkung u.a. des Paul-Ehrlich-Instituts (PEI) und des Bundesamtes für Verbraucherschutz und Lebensmittelsicherheit (BVL).
Diese Tätigkeiten sind von der Zulassung gemäß Arzneimittelrecht abgedeckt:
- Generell umfasst die Zulassung für eine klinische Prüfung die Genehmigung zur Freisetzung/zum Inverkehrbringen nach §§ 14 ff. GenTG. Dies gilt auch für Tierarzneimittel.
- Auch die längerfristige Lagerung (> 3 Tage) ist von der Zulassung mit umfasst, zB in Apotheken. Ebenso Arbeiten wie Zerstörung und Entsorgung der GVO haltigen Arzneimittel.
Diese Tätigkeiten sind NICHT von einer Zulassung des PEI abgdeckt:
- Die Herstellung GVO haltiger Arzneimittel ist eine eigenständige gentechnische Arbeit und Bedarf der Anzeige/Anmeldung gemäß GenTG.
- Werden Patientenproben analysiert und ist damit eine Vermehrung des GVO verbunden, dann ist dies ebenfalls eine eigenständige gentechnische Arbeit.
- Die Lagerung von Patientenproben länger als 3 Tage muss in einer gentechnischen Anlage stattfinden.
Denken Sie bitte daran, dass Ihre Abteilung/Klinik für die Umsetzung der Vorgaben des Gentechnikgesetzes zuständig ist und nicht ein externer Sponsor der Studie! Bitte melden Sie sich bei der Koordinatorin für Biologische Sicherheit, Dr. Sonja Voget, wenn in Ihrer Klinik/Abteilung eine Studie mit GVOs läuft bzw. geplant ist! Nur so können wir Sie optimal unterstützen.
Die Stellungnahme findet sich zB auf den Seiten des PEI.
